Au début de la pandémie de COVID-19 en mars 2020, les médecins avaient des connaissances limitées sur la façon de réagir à cette nouvelle maladie. Les médecins des régions durement touchées à travers le monde ont dû apprendre en traitant la première vague de patients, en s'appuyant sur des ventilateurs et des traitements à haut débit d'oxygène, ainsi que sur des médicaments précoces tels que l'hydroxychloroquine et le remdesivir pour réduire le risque de décès des patients. /P>
Des années plus tard, nous avons depuis vu plusieurs vaccins se révéler très efficaces pour prévenir les maladies graves. Les vaccins Pfizer/BioNTech, Moderna et Johnson &Johnson ont tous été développés en un temps record, en s'appuyant sur les recherches antérieures sur les vaccins contre les coronavirus et la technologie génétique. En décembre 2021, les adultes non vaccinés aux États-Unis étaient 2,4 fois plus susceptibles d'être testés positifs pour le COVID-19 que les adultes entièrement vaccinés et étaient 14 fois plus susceptibles de mourir de la maladie, selon les Centers for Disease Control and Prevention. La probabilité d'infection non vaccinée est passée à 2,6 fois aussi récemment qu'en janvier 2022.
Dans le même temps, les sociétés pharmaceutiques ont développé une variété de médicaments qui peuvent atténuer les symptômes du COVID-19 chez les personnes dont le test est positif. Les traitements par anticorps monoclonaux stimulent le système immunitaire, car les patients reçoivent des perfusions de protéines fabriquées en laboratoire conçues pour combattre le coronavirus. En décembre 2021, la Food and Drug Administration des États-Unis a accordé une autorisation d'urgence à un traitement par pilule antivirale qui réduit le risque d'hospitalisation et de décès liés au COVID-19. Les anticorps monoclonaux et les pilules sont plus efficaces lorsque les patients reçoivent un traitement peu de temps après le début de leurs symptômes de COVID-19.
Par rapport au fait qu'il s'agit d'une nouvelle maladie jamais connue de la science médicale, les progrès dans le développement de traitements ont été remarquablement rapides et agiles. Stacker a compilé une liste des étapes importantes dans la disponibilité des traitements et des vaccins COVID-19 au cours des deux premières années de la pandémie, en utilisant les informations des Centers for Disease Control and Prevention, de la Food and Drug Administration des États-Unis et des rapports des médias.
 1 / 10
1 / 10 Le monde a découvert le coronavirus pour la première fois fin 2019, alors que la maladie se propageait à Wuhan, en Chine. Quelques semaines après les premiers cas documentés de COVID-19, un groupe de scientifiques – y compris ceux en Chine et des collaborateurs internationaux – a publié la séquence du virus sur un site en libre accès. Le virologue Edward Holmes a partagé un lien vers la séquence sur Twitter, permettant aux chercheurs du monde entier de commencer à étudier le virus.
Ces premières recherches comprenaient le développement de vaccins chez Moderna et BioNTech, une société de biotechnologie allemande qui allait bientôt s'associer à Pfizer pour des essais cliniques. Comme ces deux entreprises travaillaient auparavant à produire des vaccins basés sur des séquences génétiques, elles ont pu adapter rapidement leur travail au coronavirus. Le premier essai clinique de Moderna pour son vaccin a débuté en mars 2020, à peine deux mois plus tard.
 2 / 10
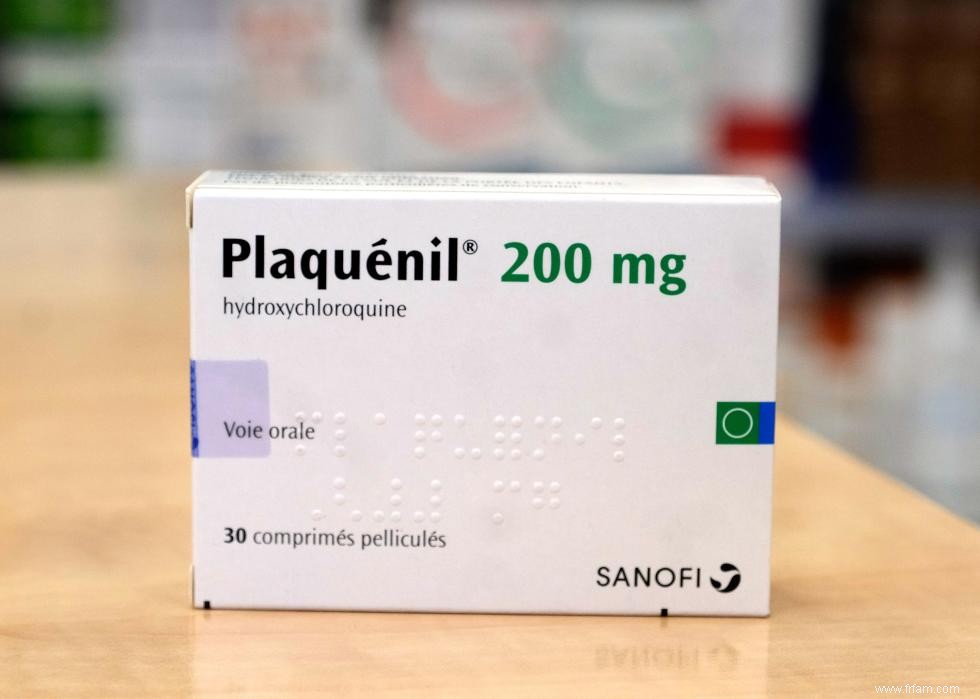
2 / 10 Au cours des premiers mois de la pandémie, les médecins traitant des patients atteints de COVID-19 gravement malades disposaient de très peu d'informations sur les médicaments ou les méthodes de traitement qui pourraient être les plus efficaces. Ce manque de connaissances a conduit certains médecins à essayer des médicaments qui n'avaient pas fait l'objet d'essais cliniques pour le COVID-19, tandis que les régulateurs ont tenté de fournir des conseils le plus rapidement possible.
Un médicament qui est devenu populaire au cours de cette période était l'hydroxychloroquine, un médicament principalement utilisé pour traiter le paludisme et certaines formes d'arthrite et de lupus. Après que certaines premières données aient suggéré que l'hydroxychloroquine pourrait également fonctionner contre le COVID-19, la FDA a fourni à ce médicament une autorisation d'utilisation d'urgence fin mars ; il a également été présenté comme un médicament miracle potentiel par le président de l'époque, Donald Trump. Cependant, d'autres essais cliniques ont montré que l'hydroxychloroquine n'aidait pas réellement à atténuer les symptômes du COVID-19, et la FDA a révoqué son autorisation en juin 2020.
 3 / 10
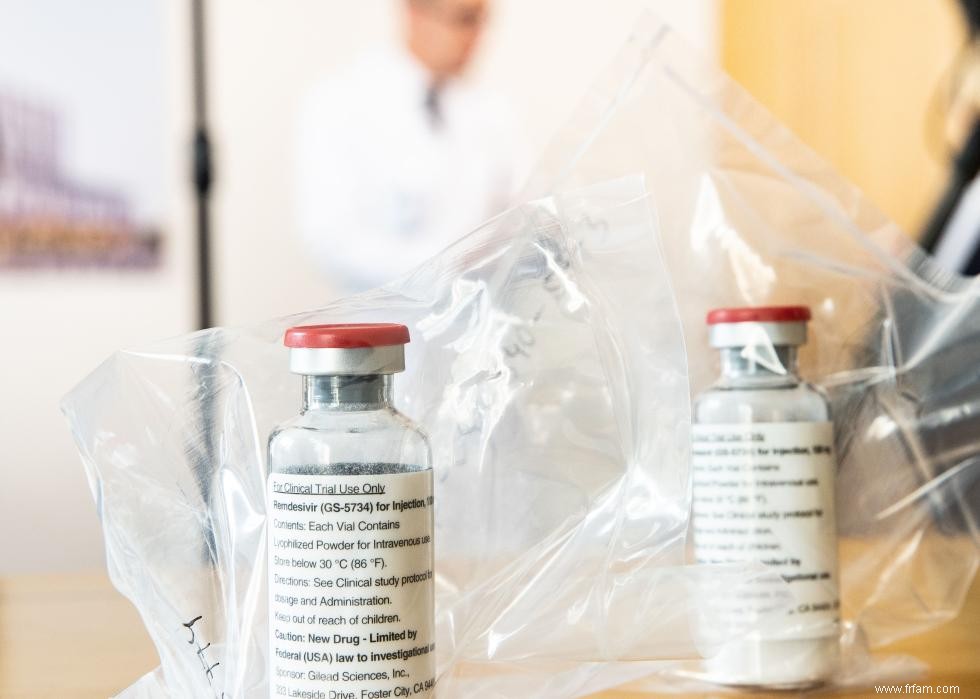
3 / 10 Remdesivir était un autre médicament précoce qui a reçu une autorisation d'utilisation d'urgence au printemps 2020. Ce médicament antiviral, fabriqué par la société biopharmaceutique Gilead Sciences, s'est avéré raccourcir le temps de récupération des patients COVID-19 dans un essai mené par les National Institutes of Health. Après son autorisation d'urgence, le gouvernement fédéral a acheté environ 500 000 traitements de remdesivir à distribuer aux hôpitaux américains entre juin et septembre 2020.
Plus tard, en 2020, les hôpitaux ont commencé à travailler directement avec Gilead pour acheter le médicament. Il est resté l'un des médicaments antiviraux les plus largement utilisés pour les patients hospitalisés COVID-19 et a été entièrement approuvé par la FDA - un processus plus rigoureux que l'autorisation d'urgence - en octobre 2020.
 4 / 10
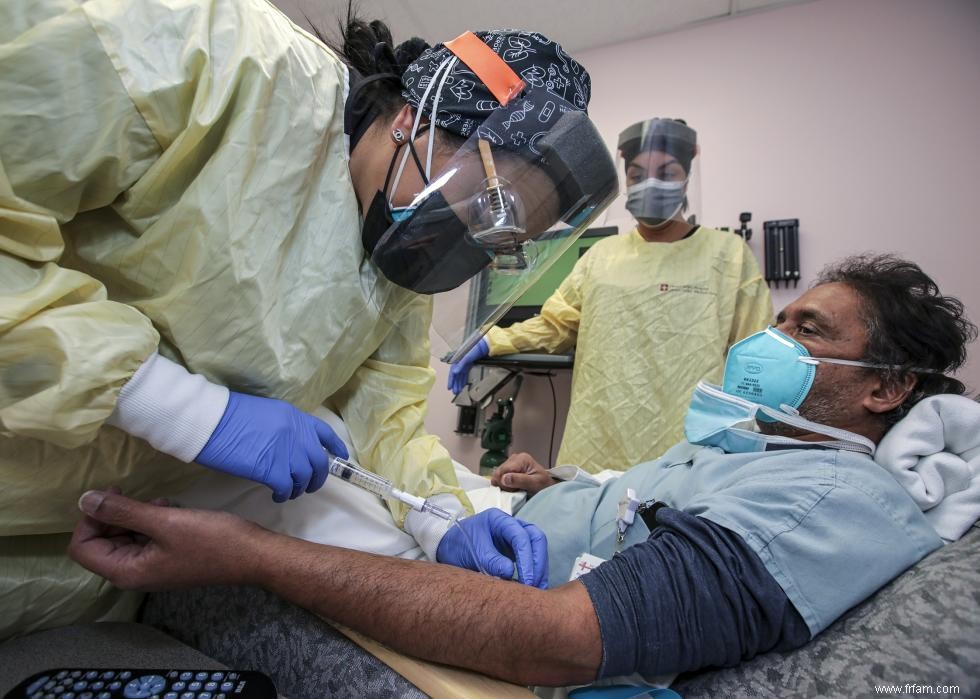
4 / 10 La société pharmaceutique Eli Lilly a été la première à commencer à tester un traitement par anticorps monoclonal pour COVID-19. Dans ces traitements, les patients reçoivent des perfusions de protéines du système immunitaire fabriquées en laboratoire qui sont conçues pour combattre le coronavirus. Les traitements stimulent efficacement le système immunitaire des patients particulièrement vulnérables aux symptômes sévères.
Le bamlanivimab, le traitement par anticorps monoclonal d'Eli Lilly, a reçu une autorisation d'utilisation d'urgence de la FDA en novembre 2020. Un traitement similaire fabriqué par Regeneron a reçu une autorisation d'urgence plus tard ce mois-là. Les deux traitements n'étaient initialement disponibles que pour les patients à haut risque dans les hôpitaux, mais ils ont été plus largement distribués en 2021.
 5 / 10
5 / 10 Moins d'un an après que des scientifiques chinois ont publiquement partagé la séquence génétique du coronavirus, deux vaccins à ARNm conçus à partir de cette séquence ont reçu une autorisation d'urgence de la FDA. De nombreux scientifiques et experts de la santé ont considéré cette chronologie rapide comme un "miracle", car aucun vaccin n'avait jamais été produit aussi rapidement dans l'histoire de l'humanité.
Les vaccins Pfizer/BioNTech et Moderna ont pu progresser si rapidement parce que BioNTech et Moderna, ainsi que les National Institutes of Health, travaillaient sur les coronavirus et la technologie basée sur les séquences génétiques depuis des années avant que le COVID-19 ne frappe. En outre, l'administration Trump a investi des milliards dans le développement et la production de vaccins grâce à "Operation Warp Speed", permettant aux vaccins COVID-19 de franchir les obstacles bureaucratiques plus efficacement.
Le déploiement du vaccin aux États-Unis a commencé le 14 décembre 2020, avec une infirmière en soins intensifs de New York qui a reçu la première dose du pays. Les travailleurs de la santé et les résidents des maisons de retraite étaient en première ligne pour les doses, suivis des personnes âgées et d'autres Américains immunodéprimés et autrement vulnérables.
 6 / 10
6 / 10 Au fur et à mesure que le déploiement du vaccin COVID-19 progressait en 2021, la vaccination est devenue de plus en plus polarisée :en janvier 2022, 91 % des personnes qui s'identifient comme démocrates ont reçu au moins une dose de vaccin, contre 63 % des personnes qui s'identifient comme républicaines, selon sondage de la Kaiser Family Foundation.
Les politiciens républicains qui hésitent à aliéner leurs bases en encourageant la vaccination se sont plutôt tournés vers les traitements par anticorps monoclonaux comme option alternative pour réduire les décès dus au COVID-19. Au cours de la poussée de Delta de l'été 2021 - qui a principalement frappé les États du Sud dirigés par les républicains où les mandats de masque ont également servi de point de basculement politique - les gouverneurs de Floride, du Texas et d'autres États voisins ont mis en place des cliniques d'anticorps monoclonaux où les résidents pouvaient recevoir ces traitements gratuitement .
À la mi-septembre, seuls sept États représentaient 70 % des commandes d'anticorps monoclonaux du gouvernement fédéral, selon le ministère de la Santé et des Services sociaux. Le HHS a répondu en prenant le contrôle de la distribution des anticorps monoclonaux, le rendant similaire au système de distribution du remdesivir en 2020.
 7 / 10
7 / 10 Huit mois après que les Américains ont commencé à recevoir le vaccin Pfizer/BioNTech sous autorisation d'utilisation d'urgence, la FDA a entièrement approuvé ce vaccin. "Le public peut être très confiant que ce vaccin répond aux normes élevées de sécurité, d'efficacité et de qualité de fabrication que la FDA exige d'un produit approuvé", a déclaré la commissaire par intérim de la FDA, Janet Woodcock, dans un communiqué à l'époque.
Certains experts en santé publique espéraient que l'approbation complète de la FDA aiderait à convaincre les Américains réticents à la vaccination - préoccupés par le calendrier rapide de développement du vaccin COVID-19 - que le vaccin de Pfizer était entièrement sûr et efficace. Cependant, les sondages et l'analyse des données par la suite ont révélé que l'approbation complète avait un impact limité sur l'adoption du vaccin. Les taux de vaccination ont légèrement augmenté fin août 2021, mais ont de nouveau chuté en septembre.
 8 / 10
8 / 10 Des millions de parents se sont réjouis début novembre 2021 lorsque la FDA et le CDC ont autorisé une version du vaccin Pfizer/BioNTech pour les enfants âgés de 5 à 11 ans. Des parents enthousiastes ont fait vacciner leurs enfants à temps pour la saison des fêtes 2021. Mais dans l'ensemble, l'adoption dans ce groupe d'âge a été faible jusqu'à présent, avec un peu plus de 28 % des enfants de ce groupe d'âge ayant reçu au moins une dose de vaccin en janvier 2022.
Pendant ce temps, les parents des plus jeunes américains (ceux de moins de 5 ans) attendent toujours l'autorisation du vaccin. En décembre 2021, Pfizer a découvert que deux doses d'une version à faible dose de son vaccin ne fournissaient pas une forte réponse immunitaire chez les enfants âgés de 2 à 4 ans ; après avoir initialement demandé l'autorisation de la FDA avec deux doses tout en continuant à tester une troisième dose, la société a reporté sa demande en février 2022 pour attendre plus de données.
 9 / 10
9 / 10 Depuis décembre 2021, les Américains infectés par le coronavirus disposent désormais de deux options de traitement qui ne nécessitent pas de perfusion dans un centre de santé. La FDA a accordé une autorisation d'urgence à deux traitements antiviraux sous forme de pilule : l'un produit par Pfizer, l'autre par Merck.
Les deux pilules agissent en bloquant la réplication du coronavirus dans le corps, ce qui réduit le risque de symptômes graves. La pilule Pfizer, appelée Paxlovid, a eu beaucoup plus de succès dans les essais cliniques :elle réduit le risque d'hospitalisation et de décès de 88 %, contre 30 % pour la pilule de Merck. Pour les deux traitements, les patients doivent obtenir une ordonnance et commencer à prendre les pilules dans les cinq jours suivant l'apparition des symptômes du COVID-19, ce qui peut être difficile, car l'approvisionnement en médicaments est limité aux États-Unis, à partir de début 2022.
 10 / 10
10 / 10 La variante Omicron a provoqué un changement majeur dans la disponibilité du traitement COVID-19, car les scientifiques d'Eli Lilly et Regeneron ont rapidement découvert que leurs anticorps monoclonaux ne fonctionnaient plus bien contre cette version du virus. Par conséquent, la FDA a limité son autorisation d'urgence pour leur utilisation. Néanmoins, certains des mêmes États du Sud qui ont popularisé ces médicaments à l'été 2021 ont continué à les fournir pendant la poussée d'Omicron malgré leur inefficacité.
Eli Lilly a répondu à la situation en développant un nouveau traitement par anticorps monoclonal, appelé bebtelovimab, efficace contre Omicron. Selon la société, ce nouveau médicament agit également contre BA.2, une lignée sœur d'Omicron qui a suscité certaines inquiétudes car il est encore plus contagieux qu'Omicron lui-même. Le gouvernement américain a acheté 600 000 cours de bebtélovimab, qui seront distribués en février et mars 2022.