La réponse à la question centrale est un peu fastidieuse. La plupart des gens ne comprennent pas l'eau parce que les cours de sciences enseignent un modèle obsolète et carrément erroné pour l'eau liquide. La science elle-même est donc responsable de notre ignorance.
Peut-être la bonne nouvelle d'abord. Les modèles scientifiques pour une molécule d'eau, la glace et la vapeur d'eau sont corrects et constituent un bon point de départ pour mieux comprendre l'eau liquide. On répète donc ces modèles avant de mettre le doigt sur la plaie.

La molécule d'eau est la pierre angulaire de l'eau. Il se compose de deux petits atomes d'hydrogène liés à un atome d'oxygène 16 fois plus lourd. La molécule est électriquement neutre, mais les centres de gravité des charges négatives et positives ne coïncident pas. Cela fait de l'eau une molécule polaire, une propriété cruciale pour comprendre le comportement des molécules d'eau. Le centre des charges négatives est plus vers l'atome d'oxygène, de sorte que les atomes d'hydrogène sont en partie chargés positivement (voir Fig. 1). La polarité de la molécule d'eau est grande par rapport aux autres molécules. Cela explique pourquoi l'eau, une molécule très légère, n'est pas un gaz mais un liquide à température ambiante.
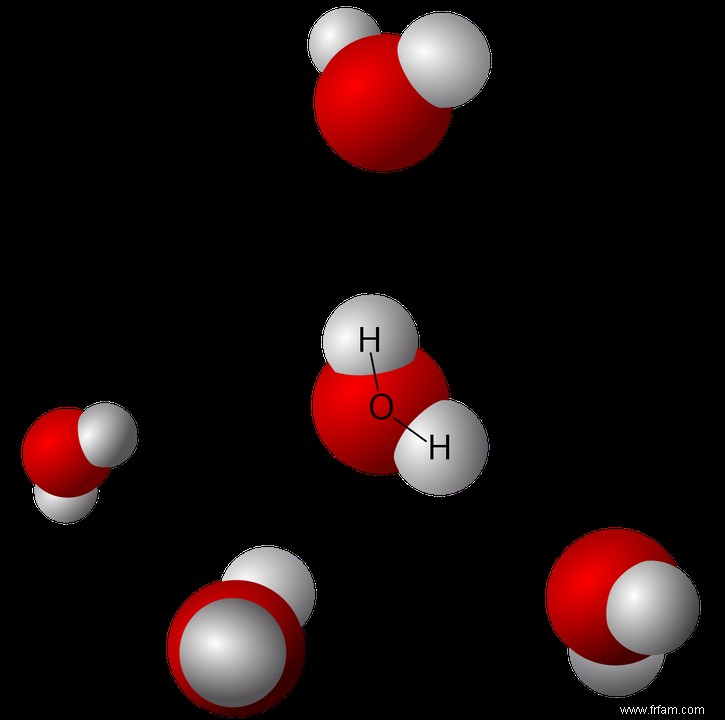
Lorsque les molécules d'eau polaires se rapprochent suffisamment, elles se lient les unes aux autres. La partie positive des atomes d'hydrogène est attirée par la partie négative des atomes d'oxygène. Cette liaison est appelée liaison hydrogène et donne une orientation spatiale aux molécules d'eau (Fig. 2). Et c'est là que les choses tournent un peu mal. Dans la plupart des manuels, ces liaisons hydrogène ne sont mentionnées que dans le contexte de l'eau, alors qu'elles jouent également un rôle important dans la glace et sont responsables de la structure solide de la glace. Seule la vapeur d'eau échappe à l'influence des liaisons hydrogène car en moyenne les molécules sont trop éloignées.
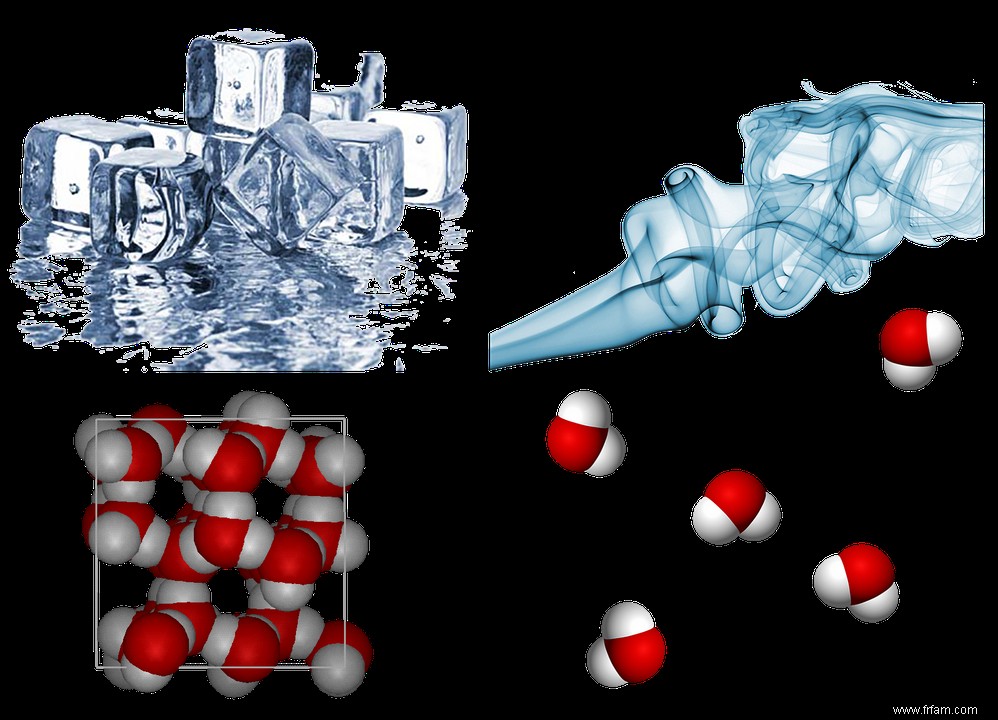
La forme de glace la plus courante a une structure cristalline hexagonale (voir Fig. 3 à gauche). Chaque molécule d'eau est fixée dans l'espace dans un réseau cristallin et est reliée à ses quatre plus proches voisins. Les relations entre les propriétés macroscopiques de la glace et le modèle microscopique sont immédiatement apparentes. La glace est solide et difficile à comprimer, tout comme son modèle microscopique.
Un modèle pour la vapeur d'eau (voir Fig. 3 à droite) est également assez évident. La vapeur d'eau a une faible densité et est facilement compressible. Dans notre modèle microscopique, les molécules d'eau ont une distance moyenne beaucoup plus grande que dans le solide. En conséquence, ces molécules se déplacent librement et au hasard dans l'espace. Aucune liaison hydrogène stable n'est possible. La faible densité et la compressibilité sont conformes à notre présentation.
Cependant, l'état liquide est plus difficile. La densité et la compressibilité de l'eau sont du même ordre de grandeur que celles de la glace. Ainsi, tout comme dans la glace, les molécules d'eau doivent être proches les unes des autres. Mais comment intégrer la fluidité de l'eau dans le modèle ?

La plupart des manuels en viennent à modéliser ces propriétés des fluides en supposant que les molécules d'eau se déplacent librement et au hasard « comme des billes dans un sac » (Fig. 4). Mais ces mêmes molécules n'étaient-elles pas également proches les unes des autres ? Pouvez-vous sentir l'humidité ?
Les professeurs de sciences se taisent actuellement sur les liaisons hydrogène et espèrent que les étudiants les plus intelligents ne le remarqueront pas. Pourquoi les liaisons hydrogène ne jouent-elles aucun rôle ici ? Dans l'eau, cette question est encore plus douloureuse qu'avec d'autres substances car les molécules de l'eau sont plus rapprochées que dans la glace. Pourquoi la polarité des molécules d'eau, qui est suffisamment forte pour former une structure de glace solide, est-elle soudainement sans importance dans cette structure d'eau plus dense ? Certains essaient de sauver le modèle du marbre en arguant que les molécules dans l'eau ont plus d'énergie thermique et briseront les liaisons hydrogène en conséquence. Mais cette réponse n'est pas très convaincante. Les différences d'énergie thermique ne sont pas vraiment importantes et à 0 °C, il existe à la fois de l'eau liquide et de la glace et leurs molécules ont la même énergie thermique.
Nous sommes maintenant au cœur du problème de l'eau. Sous couvert de simplicité didactique, nous avons fait sangloter tout le monde (même les scientifiques) avec un modèle gazeux pour les liquides. Nous leur faisons croire que les molécules liquides se déplacent librement pour rendre compte de la fluidité, négligeant les interactions fondamentales entre ces molécules.
Soit dit en passant, il existe des données solides montrant que ce modèle gazeux a été complètement tiré par les cheveux. Il suffit de comparer la chaleur latente de sublimation de la glace à 0°C (51 kJ/mol) avec la chaleur de fusion à la même température (6,0 kJ/mol). La chaleur de sublimation est l'énergie nécessaire pour casser toutes les liaisons hydrogène de la structure de la glace afin d'obtenir un gaz sans liaisons hydrogène. La chaleur de fusion est l'énergie nécessaire pour transformer la structure de la glace en une structure liquide. Les valeurs ne mentent pas. Mais 12% des liaisons sont rompues lors du processus de fusion. Un liquide n'est pas un sac de billes, la plupart des molécules d'eau sont encore liées. La fluidité n'est donc pas une question de molécules complètement libres. Il s'agit d'une structure fixe dans laquelle un nombre limité de molécules peuvent se déplacer librement.

La liquidité n'est pas une propriété des gaz mais une propriété des solides. Et ce n'est pas une idée étrange mais un modèle scientifique largement diffusé. Par exemple, la poix coulera si vous attendez assez longtemps et les glaciers de glace sont appelés rivières fixes. Le concept de liquidité est joliment développé par Veritasium dans 'Is glass liquid?' Nous sommes habitués à l'image que les liquides remplissent un récipient en quelques secondes. Les solides feront de même, mais sur une échelle de temps différente. La distinction entre liquides et solides dépend donc du temps humain et n'est donc pas aussi fondamentale qu'on le pense à première vue.
Cette prise de conscience est un premier pas loin de notre modèle gazeux obsolète pour l'eau. Bien sûr, il y a plus de liaisons hydrogène brisées dans l'eau que dans la glace, mais il reste encore suffisamment de liaisons hydrogène pour donner à l'eau une structure solide. L'eau ressemble donc plus à de la glace qu'à de la vapeur d'eau. Afin d'améliorer notre modèle de l'eau, nous devons donc regarder à nouveau l'eau complètement, mais maintenant avec des verres différents. Ce blog vous aidera à construire un modèle d'eau fondamentalement nouveau et robuste.
La version anglaise de ce blog peut être trouvée via ce lien avec les articles scientifiques sur lesquels ce nouveau modèle "solide" est basé.