William G. Kaelin Jr, Sir Peter J. Ratcliffe et Gregg L. Semenza se partagent le prix Nobel de médecine de cette année. Ensemble, ils ont découvert comment les cellules connaissent la quantité d'oxygène disponible et comment elles doivent s'y adapter.
L'importance fondamentale de l'oxygène ou O2 est connue depuis des siècles. Mais comment les cellules et les tissus s'adaptent aux changements de la quantité d'oxygène disponible est longtemps resté un mystère. Les scientifiques américains William Kaelin et Gregg Semenza et le scientifique britannique Peter Ratcliffe ont identifié le mécanisme moléculaire derrière ce processus d'adaptation essentiel.
L'oxygène est essentiel à la vie animale. Il est utilisé par les mitochondries présentes dans pratiquement toutes les cellules animales pour convertir les aliments en énergie utilisable.
Au cours de l'évolution, des mécanismes se sont développés pour fournir suffisamment d'oxygène aux tissus et aux cellules. L'artère carotide, par exemple, contient des cellules spécialisées qui mesurent le niveau d'oxygène du sang. Cette mesure de l'oxygène contrôle le rythme de notre respiration.
Grâce à ces travaux révolutionnaires, nous en savons beaucoup plus sur la façon dont les différents niveaux d'oxygène régissent les processus physiologiques fondamentaux
Une autre adaptation physiologique à la privation d'oxygène ou à l'hypoxie est l'augmentation de l'hormone érythropoïétine (EPO), qui entraîne une production accrue de globules rouges. Son importance était déjà connue au début du XXe siècle, mais la manière exacte dont ce processus était contrôlé par l'oxygène restait un mystère.
Kaelin, Ratcliffe et Semenza ont démêlé ce mécanisme. Grâce à leur travail de pionnier, nous en savons beaucoup plus sur la façon dont les différents niveaux d'oxygène régissent les processus physiologiques fondamentaux. Nous savons maintenant que les cellules peuvent adapter leur métabolisme à de faibles niveaux d'oxygène, ce qui se produit, par exemple, dans nos muscles lors d'un entraînement intensif. Le mécanisme est également essentiel au cours du développement fœtal pour la formation normale des vaisseaux sanguins et le développement placentaire. Et les tumeurs utilisent le mécanisme pour stimuler la formation de vaisseaux sanguins et inciter le métabolisme à favoriser la croissance et la propagation des cellules cancéreuses.
Les découvertes ont contribué au développement de nouveaux traitements pour lutter contre des maladies telles que l'anémie et le cancer.
Illustration ci-dessus :Le mécanisme découvert est d'une importance fondamentale en physiologie, par exemple pour notre capacité à nous adapter à l'exercice. De nombreux processus pathologiques en sont également affectés. Les découvertes pourraient conduire à de nouveaux médicaments pour le traitement de l'anémie et du cancer, entre autres.
Semenza a étudié le gène EPO et comment il est affecté par différents niveaux d'oxygène. Il a découvert des segments d'ADN spécifiques autour du gène EPO chez des souris modifiées qui jouent un rôle dans la réponse au manque d'oxygène. Ratcliffe a également étudié l'effet dépendant de l'oxygène du gène EPO. Les deux ont découvert que le mécanisme est présent dans pratiquement tous les tissus et pas seulement dans les cellules rénales où l'EPO est produite.
Semenza a voulu identifier les composants cellulaires qui déclenchent cette réaction. Dans des cellules hépatiques en culture, il a découvert un complexe protéique qui se lie au segment d'ADN identifié d'une manière dépendante de l'oxygène. Il a appelé cela le facteur inductible par l'hypoxie (HIF). Il a découvert plus tard que HIF se compose de deux protéines de liaison à l'ADN différentes, HIF-1α et ARNT. Lorsque le niveau d'oxygène est élevé, les cellules contiennent très peu de HIF-1α. Lorsque les niveaux d'oxygène sont bas, la quantité de HIF-1a augmente.
Plusieurs groupes de recherche ont ensuite montré que HIF-1α, normalement dégradé rapidement, est protégé contre la dégradation lors de la privation d'oxygène.A des niveaux d'oxygène normaux, un petit peptide, l'ubiquitine, est ajouté à la protéine HIF-1. L'ubiquitine agit comme un marqueur pour les protéines destinées à la dégradation dans le protéasome. La manière dont l'ubiquitine se lie à HIF-1α de manière dépendante de l'oxygène reste incertaine.
La réponse est venue d'un côté inattendu. À peu près au même moment où Semenza et Ratcliffe étudiaient la régulation du gène EPO, le chercheur sur le cancer Kaelin étudiait un syndrome héréditaire appelé maladie de Hippel-Lindau. Cette maladie génétique entraîne un risque considérablement accru de certains cancers dans les familles présentant des mutations héréditaires du VHL. Kaelin a montré que le gène VHL code pour une protéine qui empêche le développement du cancer.
Kaelin a également montré que les cellules cancéreuses dépourvues d'un gène VHL fonctionnel expriment des niveaux anormalement élevés de gènes régulés par la privation d'oxygène. Mais aussi que lorsque le gène VHL a été réintroduit dans les cellules cancéreuses, les niveaux normaux ont été restaurés. C'était un indice important pour montrer que le VHL était impliqué dans le contrôle des réponses à la privation d'oxygène.
Plus tard, Kaelin et Ratcliffe ont découvert que sous des niveaux d'oxygène normaux, des groupes hydroxyle sont ajoutés à deux positions spécifiques dans HIF-1α (voir l'illustration ci-dessous † Cette modification protéique, appelée prolyl hydroxylation, permet au VHL de reconnaître et de se lier à HIF-1α. Il explique comment les niveaux normaux d'oxygène régulent la dégradation rapide de HIF-1α à l'aide d'enzymes sensibles à l'oxygène.
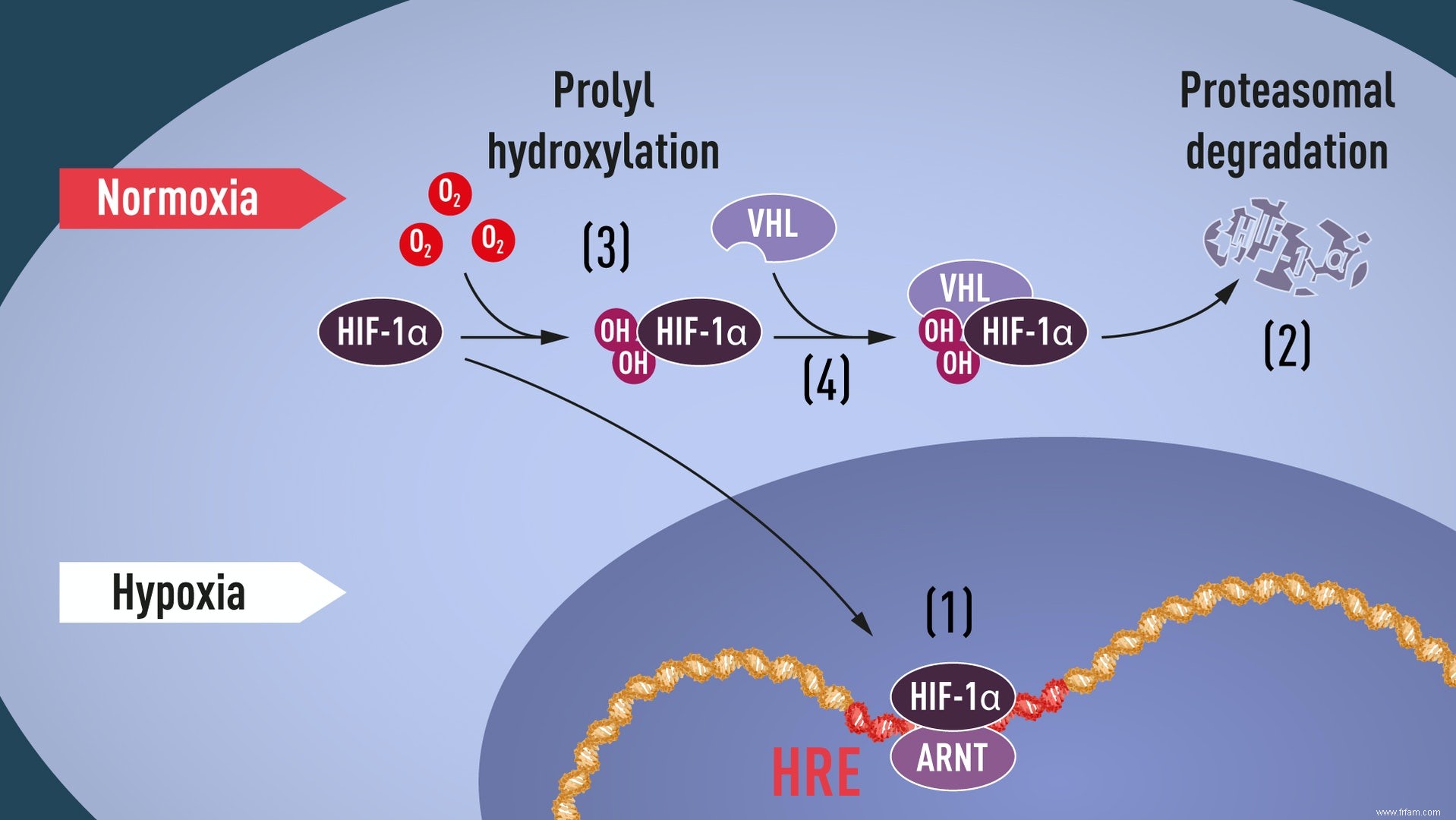
Illustration ci-dessus :lorsque les niveaux d'oxygène sont faibles (hypoxie), HIF-1a est protégé de la dégradation et s'accumule dans le noyau, où il s'associe à l'ARNT et se lie à des séquences d'ADN spécifiques (HRE) dans les gènes régulés par l'hypoxie (1) . À des niveaux d'oxygène normaux, HIF-1 est rapidement décomposé par le protéasome (2). L'oxygène contrôle le processus de dégradation en ajoutant des groupes hydroxyle (OH) à HIF-1α (3). La protéine VHL peut alors reconnaître et former un complexe avec HIF-1 conduisant à sa dégradation de manière oxygène-dépendante (4).